自从在化学课上知道液氮液氧的沸点在将近零下200度的地方,并且根据水的沸点100度来武断的推论,在标准大气压下,不会存在100度以上的液态水,因为一旦超过这个温度,水就会气化了。由此判断,液氧、液氮都必须在高压下储存,后来看the big bang theory,莱斯利在液氮里冻香蕉,我还以为是什么高科技瓶子,但是再之后看到公开课中的教授像倒水一样倒液氮,我之前的理解彻底崩溃,今天专门来分析一下,为什么液氮、液氧可以像水一样倒来倒去,而平常家用的液化石油气却是高压密封的?
首先理解一个概念—临界点(临界温度):
在热力学中,临界点是可使一物质以液态存在的最高温度或以气态存在的最高压力,当物质的温度、压力超过此界线—-即临界温度及临界压力——会相变成同时拥有液态及气态特征的流体:超临界流体。就是物质温度高于临界温度,无论加多大压力都不会变成液体了,而液氮是液体,说明,虽然装在室温的杯子中,但是其温度是在临界温度以下的。
在百度百科上的说明:
通常把在临界温度以上的气态物质叫做气体,把在临界温度以下的气态物质叫做汽。 临界温度物质处于临界状态时的温度,称为“临界温度”。降温加压,是使气体液化的条件。但只加压,不一定能使气体液化,应视当时气体是否在临界温度以下。如果气体温度超过临界温度,无论怎样增大压强,气态物质也不会液化。例如,水蒸汽的临界温度为374℃,远比常温度要高,因此,平常水蒸汽极易冷却成水。其他如乙醚、氨、二氧化碳等,它们的临界温度略高于或接近室温,这样的物质在常温下很容易被压缩成液体。但也有一些临界温度很低的物质,如氧、空气、氢、氦等都是极不容易液化的气体。其中氦的临界温度为-268℃。要使这些气体液化。必须具备一定的低温技术和设备,使它们达到它们各自的临界温度以下,而后再用增大压强的方法使其液化。
再理解一个概念—超临界流体:
超临界流体(英语:Supercritical fluid, SCF)是一种物质状态,当物质在超过临界温度及临界压力以上,气体与液体的性质会趋近于类似,最后会达成一个均匀相之流体现象。超临界流体类似气体具有可压缩性,可以像气体一样发生泻流,而且又兼具有类似液体的流动性,密度一般都介于0.1到1.0g/ml之间。
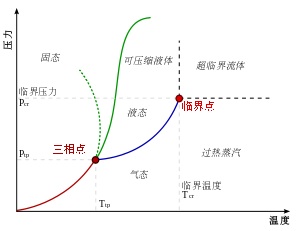
看一个二氧化碳的相图
在压力-温度的相图中,液态和气态为不同的二相,但若超过临界点,液态和气态的相态都消失了,变成单一相态的超临界流体。图2是二氧化碳密度-压力的相图,其中也可以看到类似的现象,当温度远低于临界温度280K时,随着压力的增加,气体会被压缩,最后(约40巴压力时)会凝结成密度高很多的液体,因此相图中有表示不连续的垂直虚线。此系统包括高密度的液体及低密度的气体,二者达到平衡状态。随着温度的升高,气体的密度会增加,而液体的密度会减少。在临界点304.1 K及7.38 MPa(73.8 bar)时,液体和气体的密度相同,因此变成一均匀相。
温度高于临界温度的气体无法单纯用加压的方式液化。若温度略高于临界温度(310K),压力在临界压力附近时,密度对压力的曲线几乎是垂直线,因此微小的压力变化就会使超临界流体的密度有很大的改变。像黏度、相对电容率及溶剂强度等物理量都和密度有关,在临界点附近这些物理量也会随压力有很大的变化。在温度更高时,超临界流体的行为开始类似气体,当温度到400K时,随着压力的变化,密度几乎呈线性的变化。
许多压缩气体其实都是超临界流体。例如氮的临界点是126.2 K(- 147 °C)及3.4 MPa(34巴),因此若压力容器中的氮气压力及温度大于临界点,氮气就已变为超临界流体。在室温下,氮气和氧气的温度远高于临界点,因此其特性类似气体。不过这些气体除非冷却到其临界温度以下,否则是无法液化的。
一些物质的临界压力、临界温度等性质
总体而言,超临界流体的属性介于气体和液体之间。
下面讲讲我的理解:
1,先说液氮。氮的临界点是126.2 K(- 147 °C)及3.4 MPa(34巴),液氮其温度必定是低于126.2K的,在室温且标准大气压下时,储存在钢瓶中的氮,由于氮气的沸点是77.5K,所以虽然压力不到3.4MPa,液氮的温度可以进一步判断就是其沸点77.5K,不然,如果高于沸点它们自己就会通过降温气化(沸腾)了,如果低于沸点,它会从周围吸热直到达到沸点;现在看,开始我拿水来类比氮,出发点就错了,以为在常温下出现的液氮其温度就是常温,这是错觉。就像水,虽然临界压力是22MPa,但是只要温度不高于标准气压下的沸点100度,是可以保持液态的,不管周围温度多高,只要水无法从周围吸热,其温度就不会超过100度,它就不会气化。对氮来说,出现在室温环境中,由于热效应,不可避免的要从周围吸热,由于一般放在保温杯中,只能从周围慢慢吸热,所以液氮在空气中会慢慢流失,同时液氮气化的过程中会吸热,从而保持剩余的液氮温度在沸点以下。这样就可以理解,液氮储存有一条要求就是“所有装填液态氮的容器和管线应有适当释放压力装置以避免压力过高”。液氮从从周围缓慢吸热,气化,会逐渐增加储存容器内的压力,由于室温高于其临界温度,随着液氮的缓慢吸热,所有液氮最终都会变成气态氮,因为只要在临界温度以上,无论多大压力氮气都不会液化!它会一直吸热,直到所有液氮变成气体,然后继续吸热到所有气体与周围环境温度相同,到这一步才停止热交换。而能在杯子中储存,就是因为它无法迅速从周围环境中获取大量热量,而不得不保持液态。
2,再说液化石油气。石油气中的成分主要是C3、C4的烷和烯,从上表可以看到,它们的临界温度都在90℃以上,已经高于室温。高于室温意味着,只要压力足够,它们可以以液体的形式出现在室温环境下,也就是说,煤气罐中的石油气,液态,其温度是室温,由于此时在高压环境中,它们的沸点高于室温,所以不会气化(或者说气化和液化保持着一个动态平衡);当从煤气罐中释放出来时,高压环境消失,它们的沸点瞬间变回在常温下的沸点(-40-0℃),由于其自身温度已经高于自身沸点,不需要从周围环境吸热,依靠自己降温就可以迅速气化了。所以,液化石油气无法像水一样倾倒,一旦暴露在标准大气压下,它们会迅速降温气化。
这就像燃烧与爆炸的区别,都是氧化还原反应,但是燃烧的物资需要氧化剂,只能从外向内一点点的缓慢燃烧,如果外界氧化剂提供的很慢,燃烧就会进行的很慢,氮气能在杯子里放比较长的时间,就是没有热量提供给它气化;而爆炸,自带氧化剂,一旦有了起始条件,可以迅速完成全部反应,同样,对于液化石油气,靠自身温度的提高储存了足够的热量,一旦沸点降下来,就可以迅速完成气化过程。而保持液态,同时自身温度能提高的条件就是,这个温度到达临界温度之前。
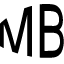


 扫一扫,打赏作者吧~
扫一扫,打赏作者吧~